Characteristics of Sap Flow of Quercus acutissima and Its Response to Environmental Factors in Laoshan Mountain
-
摘要:
以崂山自然保护区麻栎Quercus acutissima为研究对象,利用TDP插针式热扩散探针技术,在不同生长季节进行树干液流监测,并同步记录样地内空气温度、湿度、气压、风速、光合辐射和土壤温度等环境因子,分析树干液流对不同环境因子的响应特征。结果表明:树干液流日变化呈昼高夜低的单峰曲线,8月份是树干液流速率峰值和均值最高的时间段;树干液流受光合有效辐射、饱和水汽压差、空气温度和相对湿度因子的影响,检验水平为极显著(P<0.01),其中光合有效辐射是最显著的影响因子;通过多元回归分析建立了以上因子与树干液流的回归方程,决定系数为R2=0.824。
Abstract:During May and October 2021, sample plot of 1 ha was established in artificial broad-leaved forest in Laoshan Natural Reserve of Shandong. 4 trees of Quercus acutissima were selected as sample tree for determination of DBH, height, crown width, sapwood area, and at meantime, the environment factors like temperature, humidity, pressure, wind speed, photosynthetic radiation and soil temperature was measured. Sap flow of Qu. acutissima was read by TDP sap flow meter. The result demonstrated that daily variation of sap flow was a unimodal curve. The peak and average sap flow were the highest in August. The sap flow was influenced by environment factors such as photosynthetically active radiation, saturation vapor pressure difference, air temperature, and relative humidity, with extremely significant (P<0.01), especially photosynthetically active radiation. Multiple regression analysis resulted the regression equation of sap flow and environmental factors, with the decision coefficient R2 of 0.747.
-
森林生态系统在调节水分循环和小气候方面具有重要功能,其中森林的蒸腾作用是水文循环和能量平衡上的重要一环。树干液流速率和液流量与树木蒸腾耗水量有密切关系[1-2],树干液流是水分从土壤通过木质部导管提升至叶片的过程,是土壤-植物-大气连续体水流路径中的关键链接,占树木蒸腾量的90%以上,可以反映树木水分消耗特征,是衡量树木蒸腾作用及水分传输机理的一个重要生理指标[3]。树木消耗和蒸腾水分影响所在区域的小气候和水资源[4],树干液流受到自身生理生态因子和环境因子的影响,且影响程度因生态系统而异[5]。
近年来,针对不同气候区、不同林型和不同树种的树干液流和蒸腾特征的研究都显示,树干液流受到除自身生理因素以外的多种环境因子影响[6-9],主要研究因素集中在饱和水汽压差、太阳辐射、相对湿度、土壤含水率等,不同区域的树木在蒸腾速率和蒸腾量方面也有较大差距。崂山自然保护区作为胶东半岛的重要林区之一,具有巨大的生态服务功能价值,但其水源涵养价值占比不高[10, 11],有待进一步探究。麻栎Quercus acutissima广泛分布于胶东林区,多以群落伴生树种存在,少数为优势树种[12],崂山曾大面积种植麻栎人工林,具有代表性。使用热扩散探针进行树干液流监测,同时记录气温、湿度、光合辐射、风速、地下土壤温度等环境因子,分析比较环境因子对树木个体液流的影响,探明麻栎个体的蒸腾耗水规律和水分利用策略,为崂山森林质量精准提升和森林生态系统涵养水源服务功能提供参考。
1. 研究地概况
崂山自然保护区地处山东半岛,东、南两面濒临黄海,属暖温带大陆性季风气候,海岸线长87.3 km,具有海洋性气候特点,年平均降水量约662 mm,属于我国暖温带落叶阔叶林区域-暖温带落叶阔叶林地带-暖温带南部落叶栎林亚地带-胶东丘陵栽培植被、赤松Pinus densiflora麻栎林区,代表性植被类型为暖温带落叶阔叶林[13]。崂山的主要森林植被为次生林和人工林,主要植被类型有麻栎林、栓皮栎Quercus variabilis林、杂木林、刺槐Robinia pseudoacacia林、赤松林、黑松Pinus thunbergii林、日本落叶松Larix kaempferi林等,在华北地区有代表性[14-15]。崂山自然保护区植物种类繁多,植物区系成分复杂,兼有城市森林和沿海防护林功能[16]。研究样木位于崂山南坡面积为1 hm2的样地(36°8′23N,120°40′26E)内,森林类型为人工阔叶林,平均树龄40年,平均胸径16.2 cm,平均树高11.4 m,郁闭度为70%。林内混生栓皮栎、槲栎Quercus aliena、槲树Qu. dentata、枹栎Qu. serrata、赤松、油松Pinus tabuliformis、黑松等针阔叶树种,群落处于发育和演替初期。
2. 研究方法
2.1 样木选择
在观测场内选取4株麻栎样木作为研究对象,树龄相近、生长状况良好、树干通直、冠幅适中、无病虫害。分别测量其胸径、树高、冠幅,用生长锥在胸径处钻取边材样品,测量边材长度后计算得到边材面积(表1)。
表 1 样树基本信息Table 1. Sample trees编号 胸径/cm 树高/m 平均冠幅/m 边材面积/cm2 1号样木 17.1 12 4 77.2 2号样木 17.5 13 4 78 3号样木 17.2 13 4.8 76.5 4号样木 19.8 13.5 4.5 78 2.2 树干液流测定
树干边材液流速率用热扩散式边材液流探针TY-TDP-50测定,使用Campbell CR1000X数据采集器采集。热扩散液流探针包括两个带有铜—康铜热电偶的圆柱形探头和一条特殊的加热线,安装时,上面的探针使用恒定电流加热,下面的探针作为参考。当液流速度为零或很小时,两个传感器之间的温度差最大。随着液流的增强,两个传感器之间的温差减小,从而利用两个测定探针之间的温差计算出液流密度值。探针周围涂抹附带的胶泥,形成防水密封。在探针的每一边都安装1/4球状泡沫用作保护传感器的导线不受扭弯的压力,并增加探针周围的绝热效果,防止因水分接触探针杆而引起热沉效应。最后包裹防辐射薄膜,减小太阳辐射引起的温度波动。麻栎在冬季落叶后液流速率极小[17],因此数据采集时间段为2021年5月至2021年10月,时间间隔为1 h。
根据Granier经验公式[18]计算平均液流通量密度:
$$ V=119\times {\left(\frac{{\Delta T}_{m}-\Delta T}{\Delta T}\right)}^{1.233} \times 0.36 $$ (1) 式中,V为平均树干液流密度(cm3·cm−2·h−1);∆Tm为流速为零时的最大温度差(℃); ∆T测定当时的温差(℃)。
树干液流速率为平均液流通量密度与样树边材面积的乘积:
$$ \mathit{F} \mathrm= \mathit{V} \mathrm{\times } \mathit{A} _{ \mathit{s} } $$ (2) 式中,F为树干液流速率(g·h−1);As为树木边材面积(cm2)。
2.3 环境因子测定
在观测场内设有梯度监测站、辐射监测站和土壤观测场。通过CAMS620-GS梯度监测站的Vaisala HMP155温度湿度传感器监测空气温度Ta和空气相对湿度RH,HSC-TFS风速传感器监测风速Ws,通过ASP30辐射站监测光合有效辐射PAR,通过土壤观测站的Campbell CR1000X传感器测量地下40 cm土壤温度Ts。每日连续监测,记录间隔为每小时,测量时段与树干液流测量同期。
空气温湿度的协同效应采用饱和水汽压差指标表达[19],计算公式如下:
$$ \mathit{V} _{ \mathit{PD} } \mathrm{=0.611exp[17.502} \mathit{T} _{ \mathit{a} } \mathrm{/}( \mathit{T} _{ \mathit{a} } \mathrm{+240.97)](1-} \mathit{R} _{ \mathit{H} } \mathrm{/100)} $$ (3) 式中,VPD为饱和水汽压差(kPa),Ta为空气温度(℃), RH为空气相对湿度(%)。
2.4 数据处理
使用Dynamax的TDPSapVel-Analysis.xls表格处理树干液流数据,使用OriginPro2020进行统计绘图,使用SPSS23.0对液流密度与环境因子进行相关性检验和Pearson系数计算,使用逐步剔除法建立多元回归模型。
3. 结果与分析
3.1 液流速率和环境因子的变化规律
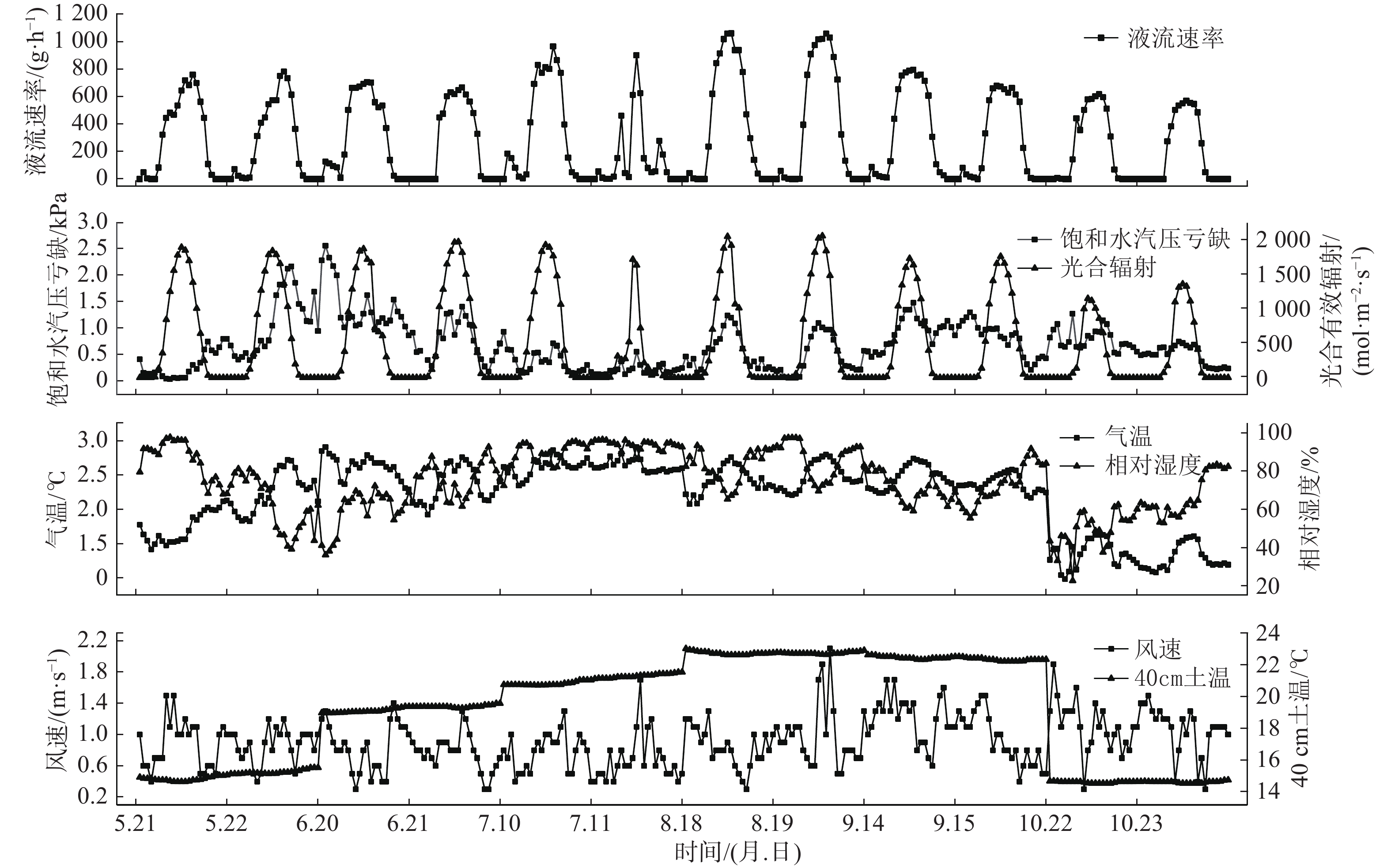
3.1.1 小时尺度下树干液流速率和环境因子的日变化规律
监测期间每月选取连续2天无降雨且晴好天气的树干液流速率和环境因子的数据变化情况显示(图1),树干液流速率日变化表现为单峰曲线,峰值多在13:00—15:00期间,夜间接近于0值,但是也有小量的树干液流。整体特征为昼高夜低,峰值前后速率变化为骤升骤降。八月的树干液流速率峰值最高,能达到1 000 g·h−1以上,液流速率峰值夏季>春季>秋季。光合辐射的变化规律与液流速率类似,在一天内呈单峰曲线,在每天的12:00左右出现峰值。在小时尺度上,液流速率受光合辐射直接影响,但是存在时滞效应[19]。地下40 cm土壤温度在同一天内几乎稳定不变,在8月、9月温度最高,7月、6月、5月、10月依次降低。饱和水汽压亏缺、空气相对湿度、风速的变化在小时尺度图上无明显规律,土壤温度和空气温度在季节尺度上对液流速率有一定影响。
3.1.2 树干液流速率和环境因子
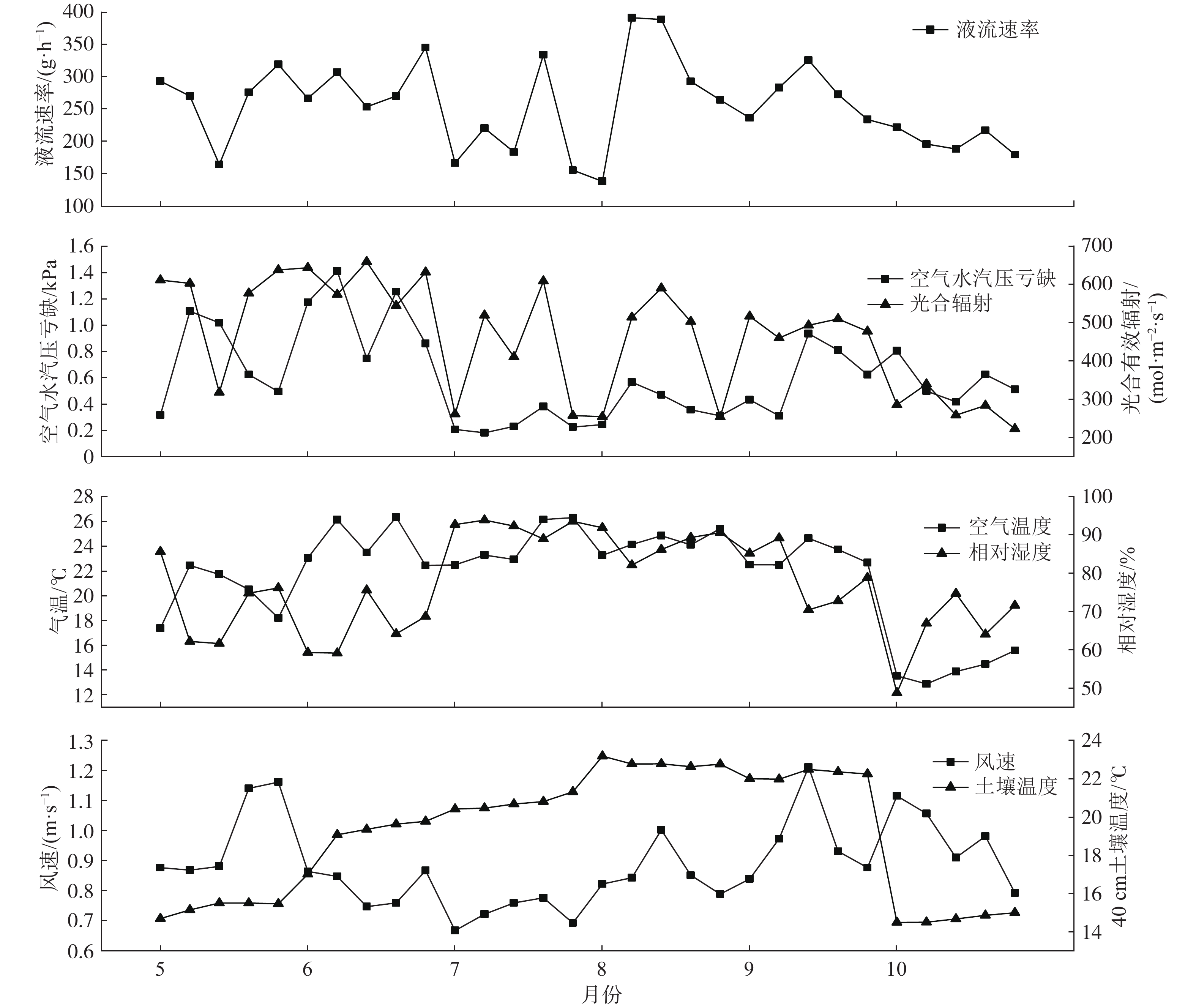
监测期间每月选取连续5天无降雨且晴好天气的日均树干液流速率和环境因子的数据变化情况显示(图2),日均树干液流速率最高值出现在8月。
3.2 环境因子对树干液流速率的影响
3.2.1 小时尺度液流密度与环境因子的相关性
为探究各个环境因子对树干液流速率的影响,每个月选取连续2 d无降雨且晴好天气的数据进行相关性分析(表2),可知树干液流速率与光合有效辐射(0.881)、空气温度(0.343)、饱和水汽压差(0.342)、空气湿度(−0.209)达到极显著检验水平(P<0.01)的相关关系。其中,与光合有效辐射、空气温度、饱和水汽压差为正相关关系,与相对湿度为负相关关系。树干液流速率的瞬时变化直接受光合有效辐射影响。
表 2 小时尺度下树干液流速率与环境因子的相关性Table 2. The correlation between hourly sap flow rate and environmental factors项目名称 液流速率
F饱和水汽压差
VPD光合有效辐射
PAR空气温度
Ta相对湿度
RH风速
WS40 cm土壤温度
TSF 1 0.342** 0.881** 0.343** −0.209 0.043 0.039 VPD 1 0.306** 0.293** −0.881** 0.155** −0.196** PAR 1 0.311** −0.167 0.087* 0.006 Ta 1 0.138** −0.173* 0.708** RH 1 −0.226* −0.497** WS 1 −0.134** TS 1 注:**表示在置信度为0.01时,相关性是显著的。*表示在置信度为0.05时,相关性是显著的。 3.2.2 日尺度下液流密度与环境因子的相关性
在监测期间的每月选取连续5d无降雨且晴好天气的日平均数据进行相关性分析(表3),可知日均树干液流速率与饱和水汽压差(−0.909)、光合有效辐射(0.964)达到极显著检验水平(P<0.01)的相关关系。其中,与光合有效辐射为正相关关系,与饱和水汽压差为负相关关系,受两者影响程度都较大。
表 3 日尺度下树干液流速率与环境因子的相关性Table 3. The correlation between daily sap flow rate and environmental factors项目名称 液流速率
F饱和水汽压差
VPD光合有效辐射
PAR空气温度
Ta相对湿度
RH风速
WS40 cm土壤温度
TSF 1 −0.909** 0.964** 0.335 −0.059 0.330 0.252 VPD 1 −0.877** 0.127 −0.846** 0.217 −0.260 PAR 1 0.379* −0.096 0.147 0.092 Ta 1 0.386* −0.433* 0.780** RH 1 −0.441* 0.615** WS 1 −0.324 TS 1 注:**表示在置信度为0.01时,相关性是显著的。*表示在置信度为0.05时,相关性是显著的。 3.2.3 树干液流速率与环境因子多元回归分析
使用逐步多元线性回归分析建立树干液流速率与相关性显著的光合有效辐射、空气温度、饱和水汽压差、相对湿度环境因子的回归方程。从各步回归分析情况(表4)看出,第4步线性回归的因变量和自变量相关性最高,决定系数R2为0.824,拟合度较高,证明树干液流速率与光合有效辐射、饱和水汽压差、空气温度和相对湿度之间存在线性关系,可以建立线性回归方程。根据第4步的回归方程的回归系数(表5),常数项b0=430.322,b1=0.421,b2=−210.198,b3=14.409,b4=−7.201,t检验显示回归系数有统计学意义,得出可建立的多元线性回归方程为:F=430.322+0.421×PAR−210.198 ×Ta+14.409×VPD−7.201×RH,决定系数R2=0.824。
表 4 逐步多元回归分析Table 4. Stepwise multiple regression analysis预测变量 R R2 调整后R2 标准估算误差 PAR 0.900a 0.810 0.809 132.336 2 PAR,VPD 0.903b 0.815 0.814 130.786 6 PAR,VPD,Ta 0.904c 0.817 0.816 130.135 5 PAR,VPD,Ta,RH 0.908d 0.824 0.819 127.672 4 注:因变量F。 表 5 回归系数和显著性检验Table 5. Regression coefficient and significance test非标准化系数 标准系数 B 标准误差 B t值 b0 430.322 90.430 4.759 b1 0.421 0.008 0.869 50.937 b2 −210.198 40.247 −0.309 −4.357 b3 14.409 2.357 0.207 6.114 b4 −7.201 1.340 −0.367 −5.375 4. 结论与讨论
4.1 麻栎树干液流变化特征
本文研究表明,崂山麻栎树干液流速率在每日的小时变化中表现为明显的骤升骤降单峰曲线,峰值大多出现在13:00—15:00期间,少量出现在12:00左右。树干液流速率有时存在午间降低的现象,原因可能是午间气温较高时叶片气孔减小或关闭,降低蒸腾作用强度以保存水分[20]。树干液流日均最高值出现在8月份,麻栎样木在夏季晴朗天气一天的树干液流量可以达到9 kg以上,蒸腾最强。以上的变化规律与刘鑫等长三角区麻栎的研究结果相近[17],区别在于崂山麻栎液流量较小,这可能与样木径级和冠幅较小以及环境因子影响有关。8月份光和有效辐射强度较大,并且是崂山区域降水量较大时期,土壤含水量增加也可导致树干液流速量增加[7]。本文没有对比研究土壤含水量不同或降雨和非降雨时期的比较,在后期的监测中将增加此部分变量分析。
4.2 环境因子对麻栎树干液流的影响情况
多数其他地区的阔叶树种相关研究表明,环境因子中的温度、湿度、太阳辐射、风速、土壤含水量与树干液流关系密切[6,21-23]。表明在小时尺度下,树干液流速率与光合有效辐射、空气温度、饱和水汽压差为正相关关系,与相对湿度为负相关关系,受光合有效辐射的影响最为显著。光合辐射峰值出现在正午时间,树干液流速率峰值大多出现在14:00—15:00期间。可以看出样树树干液流存在显著的时滞效应,这与长三角区的麻栎研究结果相近,但是时滞时长不同[17],时滞效应的产生原因包括树木液流再分配现象和不同的树种的边材传输水分效率不同[24-25],时滞特征的地域差异应该是气候等环境因子和树种特性综合作用的结果[26]。本文对风速的分析没有表现出显著相关性,将在之后进一步优化研究方法进行探讨。土壤温度对树干液流有一定的影响,并且表现出深度和季节的差异[27]。本研究增加了无雨时段地下40 cm土壤温度因子的监测,但分析结果表明较大深度的土壤温度相对稳定,对样树树干液流影响不显著。树干液流速率和光合有效辐射的变化趋势相同,且树干液流速率的瞬时变化受光合有效辐射的驱动最强。
4.3 树干液流与环境因子的多元回归分析
为综合表现各项环境因子与树干液流的关系、模拟树干液流动态变化,使用逐步回归方程分析建立线性回归方程,F=430.322+0.421×PAR−210.198×Ta+14.409×VPD−7.201×RH,R2=0.824。该方程可以简单模拟光合有效辐射、饱和水汽压差、空气温度和相对湿度对树干液流的综合影响情况。崂山麻栎的总蒸腾量较低,后续可研究同径级样木和其他地区液流差异以及主要影响因子。通过对常见环境因子的监测,可以粗略估算和判断区域气候变化对崂山麻栎蒸腾作用和消耗水分的影响情况,同时为研究麻栎树种对区域小气候和水资源的调节作用提供参考价值。树干液流所受到的影响因子不仅于此,增加降水量、土壤含水率、气孔导度、叶面积指数的研究可以不断提高预测精度,进一步探究胶东区域植物群落蒸腾耗水与环境因子之间的关系特征。
-
表 1 样树基本信息
Table 1 Sample trees
编号 胸径/cm 树高/m 平均冠幅/m 边材面积/cm2 1号样木 17.1 12 4 77.2 2号样木 17.5 13 4 78 3号样木 17.2 13 4.8 76.5 4号样木 19.8 13.5 4.5 78 表 2 小时尺度下树干液流速率与环境因子的相关性
Table 2 The correlation between hourly sap flow rate and environmental factors
项目名称 液流速率
F饱和水汽压差
VPD光合有效辐射
PAR空气温度
Ta相对湿度
RH风速
WS40 cm土壤温度
TSF 1 0.342** 0.881** 0.343** −0.209 0.043 0.039 VPD 1 0.306** 0.293** −0.881** 0.155** −0.196** PAR 1 0.311** −0.167 0.087* 0.006 Ta 1 0.138** −0.173* 0.708** RH 1 −0.226* −0.497** WS 1 −0.134** TS 1 注:**表示在置信度为0.01时,相关性是显著的。*表示在置信度为0.05时,相关性是显著的。 表 3 日尺度下树干液流速率与环境因子的相关性
Table 3 The correlation between daily sap flow rate and environmental factors
项目名称 液流速率
F饱和水汽压差
VPD光合有效辐射
PAR空气温度
Ta相对湿度
RH风速
WS40 cm土壤温度
TSF 1 −0.909** 0.964** 0.335 −0.059 0.330 0.252 VPD 1 −0.877** 0.127 −0.846** 0.217 −0.260 PAR 1 0.379* −0.096 0.147 0.092 Ta 1 0.386* −0.433* 0.780** RH 1 −0.441* 0.615** WS 1 −0.324 TS 1 注:**表示在置信度为0.01时,相关性是显著的。*表示在置信度为0.05时,相关性是显著的。 表 4 逐步多元回归分析
Table 4 Stepwise multiple regression analysis
预测变量 R R2 调整后R2 标准估算误差 PAR 0.900a 0.810 0.809 132.336 2 PAR,VPD 0.903b 0.815 0.814 130.786 6 PAR,VPD,Ta 0.904c 0.817 0.816 130.135 5 PAR,VPD,Ta,RH 0.908d 0.824 0.819 127.672 4 注:因变量F。 表 5 回归系数和显著性检验
Table 5 Regression coefficient and significance test
非标准化系数 标准系数 B 标准误差 B t值 b0 430.322 90.430 4.759 b1 0.421 0.008 0.869 50.937 b2 −210.198 40.247 −0.309 −4.357 b3 14.409 2.357 0.207 6.114 b4 −7.201 1.340 −0.367 −5.375 -
[1] 周晓峰. 中国森林与生态环境[M]. 北京:中国林业出版社,1999:95 − 99. [2] 岳广阳,张铜会,刘新平,等. 热技术方法测算树木径流的发展及应用[J]. 林业科学,2006(8):102 − 108. [3] STEPPE K,VANDEGEHUCHTE M W,TOGNETTI R,et al. Sap flow as a key trait in the understanding of plant hydraulic functioning[J]. Tree Physiol,2015,35:341 − 345. doi: 10.1093/treephys/tpv033
[4] 李广德,贾黎明,孔俊杰. 运用热技术检测树干边材液流研究进展[J]. 西北林学院学报,2008(3):94 − 100. [5] 张瑞婷,杨金艳,阮宏华. 树干液流对环境变化响应研究的整合分析[J]. 南京林业大学学报(自然科学版),2022(8):113 − 120. [6] 杨丽琳,邢万秋,王卫光,等. 新安江源区杉木树干液流速率变化及其对环境因子的响应[J]. 植物生态学报,2023,47(4):571 − 583. [7] 吕金林,何秋月,闫美杰,等. 黄土丘陵区辽东栎树干液流特征对边材面积和土壤水分的响应[J]. 应用生态学报,2018,29(3):725 − 731. [8] 马靖涵,穆艳,张瑞,等. 城市园林银杏液流变化特征及其主要影响因子[J]. 西北林学院学报,2022,37(5):72 − 79. [9] 尤海舟,王超,李冬梅. 华北平原银杏人工林蒸腾耗水特性及其环境响应[J]. 生态科学,2023,42(3):67 − 74. [10] 耿叙武. 崂山风景区森林景观动态变化及其生态效益评价[D]. 哈尔滨:东北林业大学,2003. [11] 刘志远,刘属灵,邵景安. 崂山森林生态系统服务功能及其价值评估[J]. 绿色科技,2021,23(14):9 − 11. [12] 张文馨. 山东植物群落及其物种多样性分布格局与形成机制[D]. 济南:山东大学,2016. [13] 吴征镒. 中国植被[M]. 北京:科学出版社,1980:1375. [14] 王仁卿,周光裕. 山东植被[M]. 济南:山东科学技术出版社, 2000:372. [15] 张新时,孙世洲,雍世鹏,等. 中国植被地理格局[M]. 北京:地质出版社,2007:1270. [16] 卢鹏林. 崂山森林植物群落物种多样性的垂直分布格局及影响因素分析[D]. 济南:山东大学,2013. [17] 刘鑫,张金池,王春林,等. 长三角区麻栎树干液流的季节变化特征[J]. 中国水土保持科学,2013,11(6):66 − 73. [18] GRANIER A. Evaluation of transpiration in a douglas fir stand by means of sap flow measurements[J]. Tree Physiol,1987,3(4):309 − 319. doi: 10.1093/treephys/3.4.309
[19] 孙英君,王劲峰. 一种空气饱和差区域分布的推算方法[J]. 国土资源遥感,2004,16(1):23 − 26. [20] 韩磊,展秀丽,王芳,等. 河东沙区侧柏树干液流与蒸腾驱动因子的时滞效应研究[J]. 生态环境学报,2018,27(8):1417 − 1423. [21] 徐利岗,苗正伟,杜历,等. 干旱区枸杞树干液流变化特征及其影响因素[J]. 生态学报,2016,36(17):5519 − 5527. [22] 王媛,魏江生,刘兵兵,等. 环境因子对大兴安岭南段白桦树干液流变化特征的影响[J]. 东北林业大学学报,2021,49(2):11 − 16. [23] 李少宁,鲁绍伟,赵云阁,等. 北京4种绿化树种树干液流特性对比分析[J]. 安徽农业科学,2020,48(20):111 − 116. [24] 王华,赵平,蔡锡安,等. 马占相思树干液流与光合有效辐射和水汽压亏缺间的时滞效应[J]. 应用生态学报,2008,19(2):225 − 230. [25] 梅婷婷,王传宽,赵平,等. 木荷树干液流的密度特征[J]. 林业科学,2010,46(1):40 − 47. [26] 王瑛,刘美君,杜盛. 树干液流时滞特征及影响因素研究进展[J]. 应用与环境生物学报,2023,29(2):507 − 514. [27] 徐军亮,马履一. 土壤温度对油松(Pinus tabulaeformis)树干液流活动的影响[J]. 生态学报,2008,28(12):6107 − 6112.



 下载:
下载: