Effects of Adding Different Soil Conditioners on the Physiological Response in Ficus concinna under Cd Stress
-
摘要:
以雅榕 Ficus concinna 1 年生幼苗为对象,采用Cd污染土盆栽试验,分析添加生物炭、泥炭2种土壤调理剂对雅榕苗高、地径生长量、Cd富集转移能力、叶绿素、膜质过氧化和渗透调节等的影响,研究Cd胁迫下雅榕的耐受机理及不同土壤调理剂在促进雅榕生长、增强净化能力等方面的作用。结果表明,在中度以上Cd(2.52 mg·kg−1)胁迫条件下,雅榕依靠渗透调节物质对膜质过氧化进行修复,提高叶绿素含量、维持正常光合作用,表现出对Cd胁迫较强的适应能力;添加质量比为5%的生物炭或泥炭均可有效减轻Cd胁迫对雅榕的危害,但添加5%的生物炭在促进雅榕生长、缓解Cd污染对雅榕的损伤、提升雅榕光合作用、增强雅榕净化Cd污染土壤能力等方面综合效果优于添加5%的泥炭。
Abstract:Using 1-year-old seedlings of Ficus concenna (Miq.) Miq as the experimental object, a pot experiment was conducted in soil contaminated with heavy metal Cd to analyze the effects of adding two soil conditioners, biochar and peat, on F. microcarpa growth, Cd enrichment and transfer ability, chlorophyll, membrane peroxidation, and osmotic regulation. The tolerance mechanism of F. microcarpa under Cd stress and the effects of different soil conditioners on promoting Ficus growth and enhancing purification ability were studied. The results showed that under moderate or above Cd (2.52 mg·kg−1) stress conditions, F. microcarpa relied on osmotic regulatory substances to repair membrane peroxidation, increase chlorophyll content, and maintain normal photosynthesis, demonstrating strong adaptability to Cd stress; Adding 5% biochar or peat can effectively reduce the harm of Cd stress to F. microcarpa. Adding 5% biochar has better comprehensive effects than adding 5% peat in promoting F. microcarpa growth, alleviating the damage of Cd pollution to F. microcarpa, enhancing its photosynthesis, and enhancing its ability to purify Cd contaminated soil.
-
Keywords:
- Ficus concinna /
- Biochar /
- Peat /
- Cd stress /
- Promoting effect
-
全球各地土壤面临着不同程度的复合重金属胁迫[1-2],中国南方沿海主要重金属污染物为镉(Cd)和砷(As)[3]。在20世纪90年代,浙东沿海部分地区电子废物拆解回的处理方式不合理,导致重金属以残渣态、水溶态和化合物沉淀态等多种形式在土壤中重新积聚,成为当地陆地生物尤其是植物体内重金属污染物的主要来源[4-5]。
雅榕Ficus concinna,俗称小叶榕,桑科Moraceae榕属Ficus乔木,在园林景观植物配置上多用作行道树、防风树等;由于树形优美整齐,在亚热带城市常大量密集种植[6-7]。雅榕在固碳方面效益显著[8],且对土壤中部分重金属污染物具有较强的耐受性和一定的累积作用。作为重金属污染修复的优良植物,雅榕能够有效地改善环境,常作为行道树来种植于重金属污染的工矿企业和城市污染区[9-10]。生物炭和泥炭都具有丰富的有机质和一定量的营养元素,且由于其特殊的物理特性,具备一定的吸附重金属的能力,常被用作土壤调理剂来改善土壤性质、提高土壤肥力、提升作物的产量和品质[11-13]。此外,用这两种土壤调理剂制备原料(多为废弃的生物资源)易得且价格便宜,还有助于实现生物废弃物的循环利用,是一种经济可行的技术[13]。目前,关于雅榕耐重金属胁迫的研究已有部分报道,但综合利用雅榕结合土壤调理剂,修复因电子废物污染土壤的研究鲜有报道。
本研究以雅榕为研究对象,于2022年6—11月通过重金属Cd污染土壤盆栽试验,分析在添加生物炭、泥炭2种土壤调理剂后雅榕对Cd胁迫的生理响应,探讨结合土壤调理剂对土壤Cd污染的综合修复效果,以期为发掘使用城市园林绿化树种治理Cd污染土壤提供理论依据。
1. 材料与方法
1.1 研究区概况
浙江省台州市路桥区(121°17′25″~121°40′10″E,28°26′46″~28°38′32″N),位于温黄平原东南侧,背山面海,属亚热带季风气候。路桥区峰江街道再生金属园在20世纪90年代曾是我国最大的电子废物拆解基地之一,当时拆解工艺粗放,加上小型作坊的手工操作,导致电子废物中的Cd、Cu、Pb和Zn等重金属污染物及化学污染物无法得到有效处理。拆解电子垃圾所产生的残渣、污水通过污灌、渣堆等途径进入附近的农田和水域,造成了较严重的重金属污染。
1.2 材料及方法
供试污染土壤来源于台州市路桥区峰江街道路西村试验地,距原峰江街道再生金属园1 km。采用五点取样法在试验地各设置了8 m×8 m的土壤采样区,采样深度为0~20 cm。2022年6月取土,并将该土壤进行混合、室温风干,去除肉眼可见的植物根、枯落物等,研磨后通过10目筛,进行过滤,备用。供试土壤理化性质见表1。其中,Cd含量约达到2.52 mg·kg−1,参照国家《土壤环境质量农用地土壤污染风险管控标准(试行)》(GB15618—2018)[14],是农用地Cd污染风险筛选值(0.3 mg·kg−1,pH<6.5)的8.39倍,已达到中度以上污染水平[15-16]。
表 1 土壤和土壤调理剂理化性质Table 1. Physio-chemical properties of tested soil and pasivators参数 Cd/(mg·kg−1) 有机质/(g·kg−1) pH 盐/(g·kg−1) 非污染土壤 0.13 32.20 7.03 1.06 污染土壤 2.52 31.50 6.05 1.40 生物炭 0.06 89.73 7.93 0.22 泥炭 0.12 76.16 8.16 0.42 采用盆栽室内控制试验,共设计4种处理(表2):非污染土(F)、污染土(W)、污染土+生物炭(WS)和污染土+泥炭(WN)。将预处理后的供试土壤按试验设计称量分别装入塑料盆(上口径:15.5 cm,底部直径:12.6 cm,高:11.3 cm)中,每盆装入5 kg;并每盆加入3.0 mg·kg−1复合肥(N∶P∶K=15∶15∶15)作为底肥,混匀后浇水,保持田间最大持水量的50%。添加土壤调理剂的处理每盆按土壤质量的5%拌入相应生物炭或泥炭[17],混合均匀后,再各称取5 kg装入上述规格的塑料盆中[18-20]。非污染土壤每盆5 kg,取自正常的田间土,生物炭和泥炭由浙江省农业科学院提供,其理化性质见表1。
表 2 试验设计Table 2. Experimental design处理 试验设计 F 非污染土 W Cd污染土 WS 95%Cd污染土+5%生物炭 WN 95%Cd污染土+5%泥炭 供试雅榕来源于临海市保障苗圃,2022年6月,选用1年生、地径0.2~0.3 cm和苗高26~35 cm的扦插容器苗,去掉容器苗根部基质后定植到相应的土壤处理中,每盆1株,浇透水,每个处理10株,共计40株。定植后的雅榕在遮荫大棚中进行培养,每2 d浇1次水。5个月后每个处理随机取5株盆栽,测量土壤总Cd含量与有效Cd含量,采集叶片进行丙二醛(malondialdehyde, MDA)、可溶性糖、可溶性蛋白质和叶绿素含量等指标的测定。
1.3 测定方法及数据处理
MDA含量测定采用硫代巴比妥酸法,可溶性总糖含量测定采用蒽酮法,可溶性蛋白含量测定采用考马斯亮蓝法。叶片的叶绿素含量用80%丙酮浸提法进行测定[21]。植物体内重金属Cd含量采用HNO3-HClO4(体积比为8∶2)消煮,原子吸收分光光度计测定[22],计算雅榕地下部分富集系数和转移系数[23]。
富集系数=植物地下部分重金属含量/土壤重金属含量
转移系数=植物地上部分重金属含量/植物地下重金属含量
采用Excel 2016软件整理计算数据,采用SPSS 26.0软件对数据进行单因素方差分析(one-way ANOVA),并用Duncan法(P=0.05)进行多重比较;在显著性检验中,P>0.05表示无显著相关,P<0.05表示显著相关,P<0.01表示极显著相关。使用Origin 2018软件进行数据可视化和作图。
2. 结果与分析
2.1 不同土壤调理剂对雅榕幼苗苗高和地径的影响
如表3所示,与F处理相比,其他3个处理的苗高和地径均有所增加。W处理下雅榕苗高、地径相比F处理有所增加,但增加不显著,表明在一定范围内重金属Cd胁迫对雅榕生长有正向刺激作用。WS处理下的雅榕苗高、地径均达到最大值,且与F处理、W处理差异显著(P<0.05),增幅分别为F处理的44.98%和206.67%,为W处理的25.27%和91.66%。WN处理下的雅榕苗高和F处理及W处理无显著差异,但地径与F处理差异显著(P<0.05)。试验表明施加生物炭对雅榕苗高、地径的影响最大,在重金属Cd胁迫下仍然可以显著提高雅榕的苗高和地径生长量。
表 3 不同土壤调理剂对雅榕幼苗苗高和地径的影响Table 3. Effects of different soil conditioners on the height and diameter of F. concenna seedlings处理 苗高/cm 地径/cm F 45.26±7.07b 0.30±0.10c W 52.38±3.68ab 0.48±0.13bc WS 65.62±17.95a 0.92±0.16a WN 55.21±8.18ab 0.53±0.20b 注:同列中不同小写字母表示不同处理下指标含量差异显著(P<0.05);下同。 2.2 不同土壤调理剂对雅榕根、茎、叶的Cd含量与富集转移能力的影响
由表4可以看出,3种处理条件下雅榕幼苗植物器官Cd含量排序都为根>茎>叶,且根Cd含量大于茎和叶Cd含量的总和,说明根部是植物吸收、积累、富集Cd的主要器官。WS处理下雅榕Cd总含量、根Cd含量在3种处理中最高,叶Cd含量最低且与其他3种处理差异显著(P<0.05),WN处理下雅榕根、茎、叶Cd含量及总含量与W处理相比均无显著差异(P>0.05)。
表 4 不同土壤调理剂对雅榕幼苗根、茎、叶和土壤Cd含量的影响Table 4. Effects of different soil conditioners on Cd content in roots, stems, leaves and soil of F. concenna seedlings处理 植物器官 土壤总Cd含量/
(mg·kg−1)土壤有效Cd含量/
(mg·kg−1)富集系数 转移系数 根/(mg·kg−1) 茎/(mg·kg−1) 叶/(mg·kg−1) W 0.23±0.11a 0.08±0.01a 0.05±0.01a 0.75±0.11a 0.23±0.01a 0.32±0.07b 0.74±0.04a WS 0.30±0.06a 0.07±0.01a 0.03±0.01b 0.72±0.06a 0.17±0.01a 0.44±0.03a 0.32±0.05b WN 0.21±0.11ab 0.08±0.03a 0.04±0.02ab 0.76±0.07a 0.22±0.01a 0.28±0.06b 0.67±0.14a 植物的富集系数与转移系数能够反映植物对重金属的富集、吸收和转运能力 [24]。对于园林植物来说,富集系数越大说明其对土壤的修复效果越好。WS处理和W处理相比,富集系数显著增加(P<0.05),转移系数显著性降低(P<0.05)。这表明施加生物炭可增强雅榕富集吸收Cd的能力,抑制Cd的转移速率,使重金属Cd富集在根部,减弱重金属Cd胁迫对地上部分的影响,保持地上部分较高的生理活性,增强雅榕净化Cd污染土壤的能力。WN处理与W处理相比,雅榕根、茎、叶Cd含量及富集转移系数无显著差异(P>0.05),表明施加泥炭对雅榕在Cd污染土中的富集转移能力影响不大。
土壤总Cd含量按由大到小的顺序为W处理>WN处理>WS处理,结果表明施加不同土壤调理剂均可降低土壤总Cd含量。然而,3个处理中土壤总Cd含量无没雨有显著差异(P>0.05)。土壤有效Cd含量在WS处理下最低,与W处理相比,WS处理对土壤有效Cd含量降幅达到26.08%,达到差异显著性水平(P<0.05),但W处理土壤有效Cd含量与WN处理无显著差异(P>0.05),表明施加生物炭主要以降低土壤有效Cd含量来缓解雅榕受到的Cd胁迫。2种土壤调理剂相比,施加生物炭在降低土壤中有效Cd含量方面的作用效果优于施加泥炭。
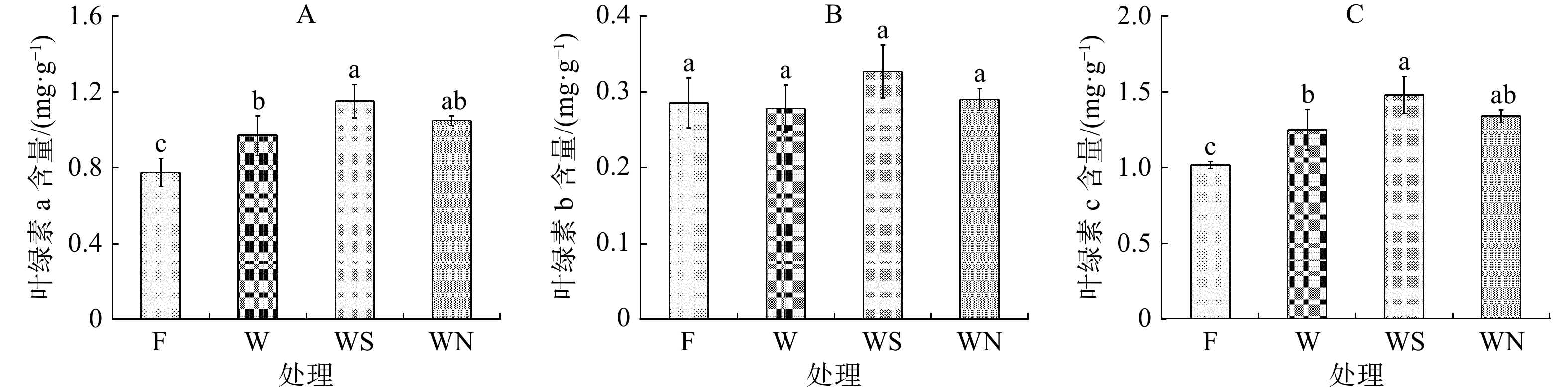
2.3 不同土壤调理剂对雅榕幼苗叶绿素a含量、叶绿素b含量和叶绿素总含量的影响
由图1可以看出,与F处理相比,W处理、WS处理和WN处理下叶绿素a、叶绿素总含量均显著升高(P<0.05),叶绿素b无显著差异,说明雅榕在面对Cd重金属胁迫时,主要通过提升叶绿素a含量来缓解Cd重金属胁迫造成的损伤。由图1A可以看出,WS处理叶绿素a含量最高,与F处理相比差异显著(P<0.05),与W处理相比差异显著(P<0.05),增幅分别为49.35%和18.56%,但与WN处理相比差异性不显著(P>0.05)。WN处理与F处理相比可显著提高雅榕叶绿素a含量(P<0.05),与W处理相比同样具有提升效果,但提升效果不显著(P>0.05)。可见雅榕在重金属Cd胁迫条件下,施加生物炭提高雅绿素含量的效果优于施加泥炭。
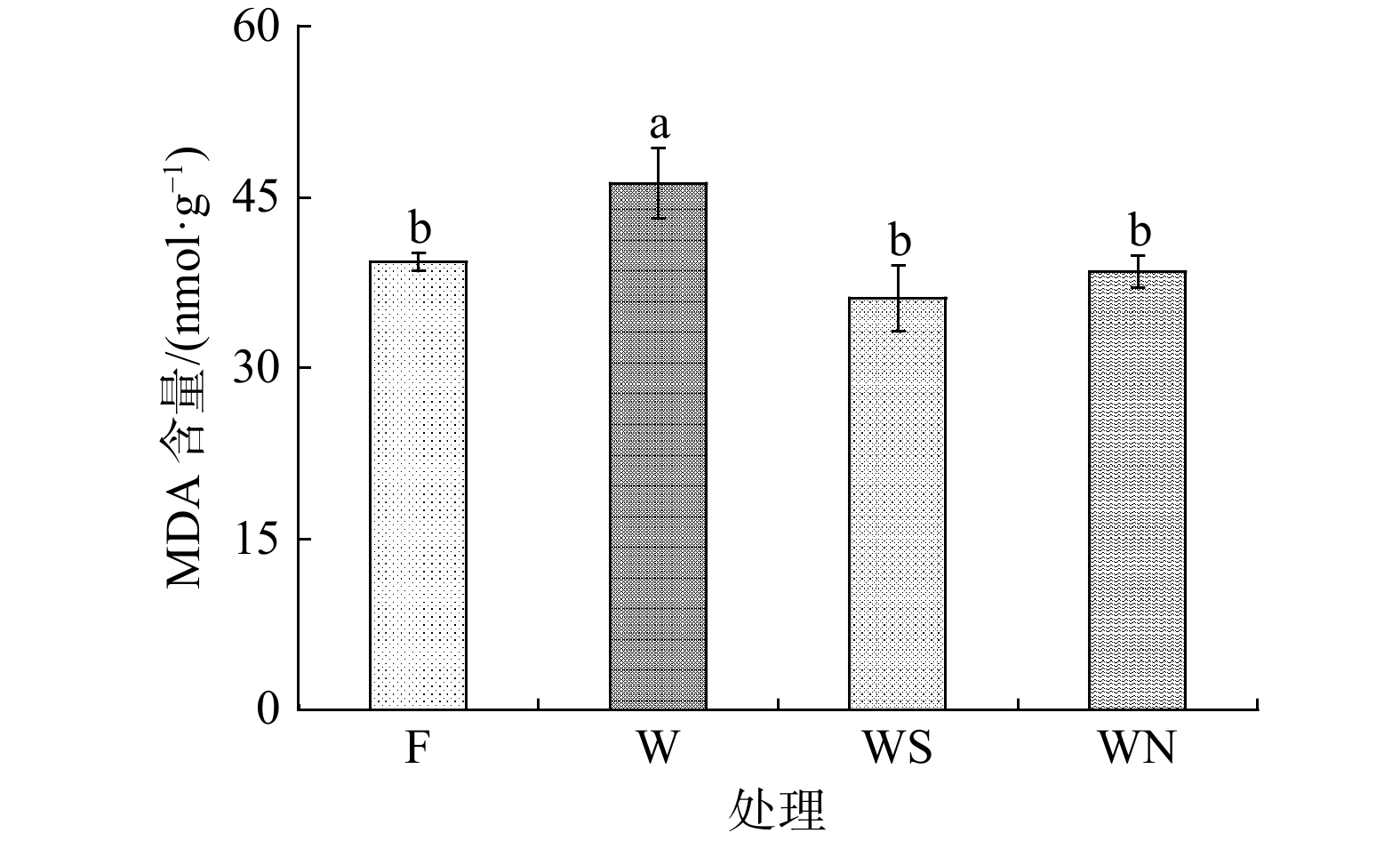
2.4 不同土壤调理剂对雅榕幼苗MDA含量的影响
植物体内MDA含量是衡量细胞受损程度的重要指标,MDA含量越大表示细胞受损越严重[25]。由图2可以看出,与W处理相比,WS处理和WN处理下雅榕MDA含量显著降低(P<0.05),降幅分别为21.82%和16.71%。WS处理下雅榕MDA含量降幅大于WN处理,表明施加生物炭的效果优于施加泥炭。与F处理相比,WS处理和WN处理下雅榕MDA含量无显著差异,甚至略微低于F处理;表明施加生物炭和泥炭均可有效缓解重金属Cd胁迫对雅榕造成的损伤,在一定范围内的重金属Cd胁迫下可帮助雅榕恢复到正常水平。
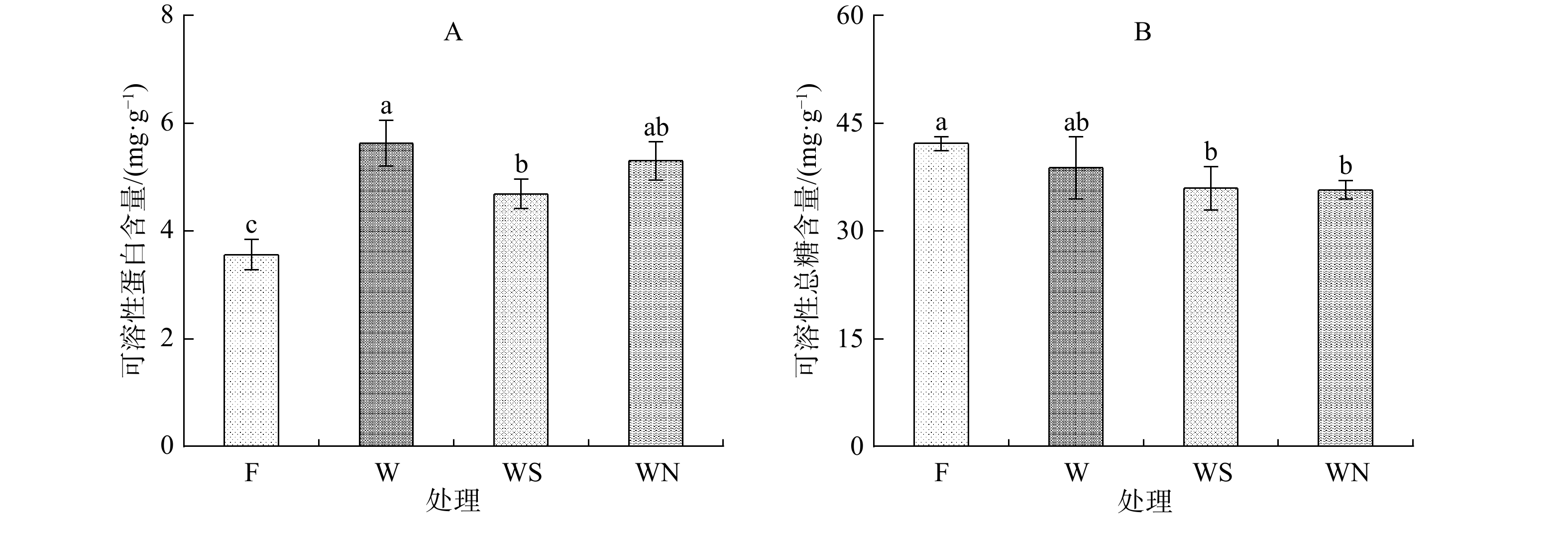
2.5 不同土壤调理剂对雅榕幼苗可溶性蛋白含量和可溶性糖含量的影响
细胞受损严重可导致可溶性总糖、可溶性蛋白等渗透压调节物质外流,使细胞中可溶性总糖、可溶性蛋白等含量增加[26]。由图3A可以看出,与F处理相比,W处理下的雅榕可溶性蛋白含量大幅度上升,增幅为58.02%,差异显著(P<0.05)。与W处理相比,WS处理下雅榕可溶性蛋白含量降幅为17.78%,差异显著(P<0.05);WN处理下降幅为5.78%,差异不显著(P>0.05),这表明施加生物炭缓解雅榕损伤的效果优于施加泥炭。由图3B可以看出,4种处理雅榕可溶性糖含量由大到小的排序为F处理>W处理>WS处理>WN处理,但W处理、WS处理和WN处理无显著差异(P>0.05),说明在重金属Cd胁迫条件下施加生物炭和泥炭后对雅榕可溶性总糖含量影响不大。
3. 讨论
植物形态和生长状况能直观反映其生存环境适宜与否,当植物受到盐胁迫或Cd重金属胁迫时,植物的组织和器官均受到抑制,生理代谢活动受到阻碍,这体现在植物植株矮化和叶片发黄等表观特征上[27-28]。本研究结果发现,W处理下的雅榕与F处理下的雅榕相比,苗高、地径和叶绿素含量均有所升高,这种典型的Hormesis效应[29],反映了雅榕对重金属Cd有较强的耐受性。对比WS处理和WN处理发现,施加生物炭对雅榕生长显著高于施加泥炭,表明生物炭所提供的有机质和营养物质更易于雅榕吸收。
雅榕体内Cd含量在各个部位的分布表现为根>茎>叶。此外,茎、叶中Cd含量远远小于根部的Cd含量,说明根部是植物吸收、积累、富集Cd的主要器官,这与大多数植物对重金属的累积特性相似[30]。根据雅榕地上部分和地下部分Cd含量、土壤中总Cd含量和有效Cd含量分析得出:施加生物炭在显著增加雅榕富集重金属Cd能力的同时,降低重金属Cd在体内的转移系数,使雅榕可以富集的重金属Cd更多地停留在地下部分,减少重金属Cd对地上部分的影响。这样既保障雅榕正常生长,又增加对土壤中重金属Cd的吸收,与汤健等[31]的研究结果一致。此外,四个处理相比,叶绿素a含量差异性显著(P<0.05),叶绿素b含量无显著差异(P>0.05),说明各处理条件下叶绿素含量的响应主要由叶绿素a含量决定,而叶绿素含量的变化可以反映植物对逆境胁迫的适应性[32-33]。叶绿素含量与光合作用密切相关[33],施加生物炭对雅榕叶片叶绿素a含量增益效果最好,表明生物炭增强了雅榕的光合作用,从而使雅榕在面对重金属Cd胁迫时保持较高的生理活性[34]。
在重金属Cd胁迫条件下,植物体内会产生过量的过氧化物,从而破坏细胞膜结构,导致植物细胞膜透性增大,造成可溶性总糖和可溶性蛋白等渗透压调节物质流向外部,细胞内渗透压调节物质增多[26]。植物体内MDA含量可以反映膜脂过氧化程度,是衡量细胞受损程度的重要指标[25]。W处理下雅榕MDA含量、可溶性总糖含量、可溶性蛋白含量相比F处理显著上升,说明此时膜质过氧化反应较大,膜系统受损程度较重,植物受到Cd胁迫伤害程度较大。WS处理、WN处理与W处理相比,有关雅榕抗性生理指标MDA含量、可溶性总糖含量、可溶性蛋白含量均显著下降,表明施加生物炭或泥炭均可有效缓解重金属Cd胁迫对雅榕的损伤。WS处理和WN处理相比,MDA含量、可溶性总糖含量、可溶性蛋白含量差异不显著(P>0.05),表明生物炭和泥炭均可减轻重金属Cd对雅榕的毒性,但生物炭对雅榕的增效效果更好。
4. 结论
中度以上 Cd(2.52 mg·kg−1)污染土壤条件下,雅榕幼苗未出现中毒枯萎现象,苗高和地径生长没有受到抑制,甚至略微增强,雅榕表现出对Cd污染较强的适应性。施加生物炭和泥炭后均可显著降低雅榕幼苗MDA含量与渗透压调节物质含量,表明施加生物炭与泥炭后均可有效缓解雅榕受到的损伤。施加生物炭可显著提高雅榕在面对重金属Cd胁迫时的苗高、地径生长量与叶绿素含量,增强富集能力,降低转移系数,显著促进雅榕光合作用能力与净化污染物Cd的能力,而施加泥炭综合促进效果不显著。综合分析认为,单独施加质量比为5%的生物炭在缓解Cd污染对雅榕的损伤、促进雅榕光合作用、增强雅榕净化Cd污染土壤能力方面综合效果优于单独施加5%的泥炭。本研究结果为发掘使用城市园林绿化树种治理Cd污染土壤提供了一种新的尝试,但温室盆栽试验的生长环境与自然环境还存在差异,后续还需要野外试验进行验证。
-
表 1 土壤和土壤调理剂理化性质
Table 1 Physio-chemical properties of tested soil and pasivators
参数 Cd/(mg·kg−1) 有机质/(g·kg−1) pH 盐/(g·kg−1) 非污染土壤 0.13 32.20 7.03 1.06 污染土壤 2.52 31.50 6.05 1.40 生物炭 0.06 89.73 7.93 0.22 泥炭 0.12 76.16 8.16 0.42 表 2 试验设计
Table 2 Experimental design
处理 试验设计 F 非污染土 W Cd污染土 WS 95%Cd污染土+5%生物炭 WN 95%Cd污染土+5%泥炭 表 3 不同土壤调理剂对雅榕幼苗苗高和地径的影响
Table 3 Effects of different soil conditioners on the height and diameter of F. concenna seedlings
处理 苗高/cm 地径/cm F 45.26±7.07b 0.30±0.10c W 52.38±3.68ab 0.48±0.13bc WS 65.62±17.95a 0.92±0.16a WN 55.21±8.18ab 0.53±0.20b 注:同列中不同小写字母表示不同处理下指标含量差异显著(P<0.05);下同。 表 4 不同土壤调理剂对雅榕幼苗根、茎、叶和土壤Cd含量的影响
Table 4 Effects of different soil conditioners on Cd content in roots, stems, leaves and soil of F. concenna seedlings
处理 植物器官 土壤总Cd含量/
(mg·kg−1)土壤有效Cd含量/
(mg·kg−1)富集系数 转移系数 根/(mg·kg−1) 茎/(mg·kg−1) 叶/(mg·kg−1) W 0.23±0.11a 0.08±0.01a 0.05±0.01a 0.75±0.11a 0.23±0.01a 0.32±0.07b 0.74±0.04a WS 0.30±0.06a 0.07±0.01a 0.03±0.01b 0.72±0.06a 0.17±0.01a 0.44±0.03a 0.32±0.05b WN 0.21±0.11ab 0.08±0.03a 0.04±0.02ab 0.76±0.07a 0.22±0.01a 0.28±0.06b 0.67±0.14a -
[1] FEILI L,HUI J,XINGFEI W,et al. Remediation for trace metals in polluted soils by turfgrass assisted with chemical reagents. [J]. Chemosphere,2022,295 :133790 − 133790.
[2] 环境保护部,国土资源部. 全国土壤污染状况调查公报(2014年4月17日)[J]. 环境教育,2014(6):8 − 10. [3] ZHONG X,CHEN Z,LI Y,et al. Factors influencing heavy metal availability and risk assessment of soils at typical metal mines in Eastern China [J]. Journal of Hazardous Materials,2020,400 123289 − 123289.
[4] HOU D Y,O’CONNOR D,IGALAVITHANA A D,et al. Metal cont amination and bioremediation of agricultural soils for food safety and sustainability[J]. Nature Reviews Earth & Environment,2020,1(7):366 − 381.
[5] WEI B,YANG L. A review of heavy metal contaminations in urban soils,urban road dusts and agricultural soils from China[J]. Microchemical Journal,2009,94(2):99 − 107.
[6] 黄一亭,李小梅,李润唐,等. 湛江市主要园林树木虫害类型及防治方法综述[J]. 现代园艺,2023,46(21):86 − 89. doi: 10.3969/j.issn.1006-4958.2023.21.028 [7] 苏琦,段婷婷,陈杰,等. 热带滨海城市行道树结构与健康评估[J]. 热带农业科学,2023,43(12):55 − 66. [8] 郑殊红. 榕树和天竺桂落叶剂研究与应用 [D]. 福州:福建农林大学,2019. [9] 黄晓霞,匡经舸,李琬婷,等. 铅镉胁迫对小叶榕叶片细胞超微结构的影响[J]. 西南林业大学学报(自然科学),2017,37(6):41 − 47. [10] 付建和,郭玉华. 泥炭在农业上的开发利用[J]. 农民致富之友,2002(11):11 − 12. [11] 李宇轩,李炎,李中文,等. 活性污泥和泥炭土有机质分子组成差异及其对有机污染物的吸附影响[J]. 环境化学,2022,41(8):2752 − 2760. [12] 王续栋,李文军,薛亚云,等. 鉴湖国家湿地公园泥炭对小青菜生长和土壤肥力的影响[J]. 浙江农业科学,2023,64(11):2669 − 2672. [13] YIN M M,BAI X A,WU D P,et al. Sulfur-functional group tunning on biochar through sodium thiosulfate modified molten salt process for efficient heavy metal adsorption[J]. Chemical Engineering Journal,2022,433(1):10.
[14] 国家环境保护局,国家技术监督局. 土壤环境质量标准:GB15618—1995 [S]. 北京; 中国标准出版社. 1995:1−3. [15] 孙华,谢丽,张金婷,等. 基于改进内梅罗指数法的棕(褐)地周边土壤重金属污染评价[J]. 环境保护科学,2018,44(2):98 − 102. [16] 刘红,贾英,方明 等. 台州市路桥农业土壤中重金属的污染分析[J]. 山西大学学报(自然科学版),2013,36(2):294 − 300. [17] 侯潞瑶,张晓勉,叶胜忠,等. 红叶石楠结合泥炭调理剂修复Cd污染土壤的研究[J]. 北方园艺,2023(13):77 − 84. [18] 李伟亚,刘希灵,李志贤,等. 生物炭对湘潭锰矿区土壤重金属的固化效应[J]. 生态环境学报,2018,27(7):1306 − 1312. [19] 王红,夏雯,卢平 等. 生物炭对土壤中重金属铅和锌的吸附特性[J]. 环境科学,2017,38(9):3944 − 3952. [20] 潘丽萍,张鹏,方培结,等. 不同改良剂对剑麻累积土壤重金属的影响[J]. 西南农业学报,2014,27(4):1632 − 1636. doi: 10.3969/j.issn.1001-4829.2014.04.057 [21] 张志良,瞿伟箐. 植物生理学实验指导 [M]. 北京:高等教育出版社,2004,123−124. [22] 王北洪,马智宏,付伟利. 密封高压消解罐消解-原子吸收光谱法测定土壤重金属[J]. 农业工程学报,2008,24(2):255 − 259. doi: 10.3321/j.issn:1002-6819.2008.02.048 [23] 侯文焕,廖小芳,唐兴富,等. 不同黄麻品种对重金属镉和铅的吸收与富集规律[J]. 西南农业学报,2020,33(9):2075 − 2081. [24] 方松林. 不同园林植物对土壤重金属的吸收及修复效应[J]. 江苏农业科学,2017,45(14):210 − 214,22. [25] MELONI D A,OLIVA M A,MARTINEZ C A,et al. Photosynthesis and activity of superoxide dismutase,peroxidase and glutathione reductase in cotton under salt stress[J]. Environmental and Experimental Botany,2003,49(1):69 − 76. doi: 10.1016/S0098-8472(02)00058-8
[26] 向书琴,胡春玉,黄宝兰,等. 内生细菌在镉胁迫下对苎麻幼苗生理生化特性的影响[J]. 智慧农业导刊,2023,3(6):22 − 25. [27] 段晓清,赵广,张扬建,等. 云南干热河谷辣木(Moringa oleifera)对Cd-Pb-Cu-Zn四种复合重金属胁迫的响应及富集特征[J]. 生态学杂志,2023,42(12):2817 − 2827. [28] KAIVAN B, AHMAD SADAT N S, ALI IZADI D, et al. Molecular mechanisms of plant salinity tolerance:a review [J]. Australian Journal of Crop Science,2015,9(4):321-336.
[29] 沈洪艳,韩冬旭,杨雷,等. 外加碳源对抗生素诱导大肠杆菌Hormesis效应的调控作用[J]. 生态毒理学报,2023,18(5):156 − 164. [30] 石元值,阮建云,马立峰,等. 茶树中镉、砷元素的吸收累积特性[J]. 生态与农村环境学报,2006(3):70 − 75. doi: 10.3969/j.issn.1673-4831.2006.03.018 [31] 汤建,倪国荣,王婉菁,等. 紫云英翻压条件下生物炭施用量对水稻Cd迁移积累的影响[J]. 江西农业大学学报,2021,43(6):1232 − 1240. [32] 潘瑞炽. 植物生理学 [M]. 北京:高等教育出版社,2001:57−62. [33] 韩淑敏,杨立科,布和,等. 重金属镉及盐胁迫对白榆幼苗生理特性的影响[J]. 森林工程,2022,38(6):19 − 26. [34] BARON M,ARELLANOJ B,GORGE J L. Copperand photosystem Ⅱ:A controversial relationship[J]. Physiologia Plantarum,2010,94(1):174 − 180.



 下载:
下载: